INFORME DE LOS VÍDEOS
1.- Grupo VII-A:

ELEMENTOS:
- F
- Cl
- Br
- I
- At
PROPIEDADES GENERALES DE LOS HALÓGENOS
Son muy reactivos, forman haluros, también forman oxácidos y ácidos. Con tiene el flúor que es el elemento más oxidante que hay y el más difícil de obtener.
FLÚOR
Propiedades físicas:

Propiedades químicas:
• Es capaz de formar un mayor número de compuestos que otros elementos.
• Baja energía de disociación de la energía de la molécula.
• Gran energía de enlace.
• Extrema electronegatividad.
DESCUBRIMIENTO:
El primer compuesto de flúor que se conoce data de los años 1500, que era antes llamado flúores, y era utilizado como fundente para fundir otros materiales.
UBICACIÓN:
El flúor es uno de los principales residuos de la fabricación de aluminio, lo podemos encontrar en muchas partes, en algunas rocas y suelos volcánicos pueden tener concentraciones de flúor.
CONTAMINACIÓN:
Se da más que todo cuando el flúor se encuentra en estado de fluoruro. El fluoruro de hidrógeno es un gas cáustico que, inhalado, puede lesionar gravemente las vías respiratorias e irritar la piel y ojos; es además un potente fitocida. Algunos compuestos de flúor en el aire pueden contribuir a la formación de lluvia ácida.
CLORO
PROPIEDADES:
Propiedades físicas:
Propiedades químicas:
El cloro elemental es un oxidante. Interviene en reacciones de sustitución, donde desplaza a los halógenos menores de sus sales. Por ejemplo, el gas de cloro burbujeado a través de una solución de aniones bromuro o yoduro los oxida a bromo y yodo, respectivamente.
DESCUBRIMIENTO:
El cloro fue descubierto en su forma diatómica en 1774 por el sueco Carl Wilhelm Scheele, aunque creía que se trataba de un compuesto que contenía oxígeno.
UBICACIÓN:
El cloro se encuentra en la naturaleza combinado con otros elementos formando principalmente sales iónicas; como es el caso del cloruro sódico y cálcico; también con la mayoría de metales; desde el cloruro de hafnio hasta el cloruro de plata.
CONTAMINACIÓN:
Según la Agencia de Protección Ambiental de los Estados Unidos (EPA), el cloro se utiliza en los procesos de producción de químicos inorgánicos y orgánicos, sin embargo, estos procesos pueden dar lugar a emisiones de mercurio a la atmósfera.
BROMO
PROPIEDADES:
Propiedades físicas:

Propiedades químicas:
Son elementos halógenos entre los que se encuentra el bromo, son oxidantes. Muchos compuestos sintéticos orgánicos y algunos compuestos orgánicos naturales, contienen elementos halógenos como el bromo. A este tipo de compuestos se los conoce como compuestos halogenados.
DESCUBRIMIENTO:
El bromo fue descubierto en 1826 por Antoine-Jérôme Balard, pero no se produjo en cantidades importantes hasta 1860.
UBICACIÓN:
El bromo es escaso en la corteza terrestre, se encuentra en el mar y en depósitos salinos en forma de bromuros. Es un líquido de color rojo parduzco y olor fuerte, despide vapores tóxicos. Entra en la composición de la púrpura, y actualmente se usa en la fabricación de antidetonantes, fluidos contra incendios, productos farmacéuticos y gases de combate.
CONTAMINACIÓN:
Los bromuros orgánicos son a menudo aplicados como agentes desinfectantes y protectores, debido a sus efectos perjudiciales para los microorganismos. Cuando se aplican en invernaderos y en campos de cultivo pueden ser arrastrados fácilmente hasta las aguas superficiales, lo que tiene efectos muy negativos para la salud de las daphnia, peces, langostas y algas.
YODO
PROPIEDADES:
Propiedades físicas:
Propiedades químicas:
- Forma cristales grises con brillo metálico
- se sublima con facilidad sin pasar por el estado liquido
- su electronegatividad es de 2.55
- su radio atómico es de 2.16(-1), 0.50(7)
DESCUBRIMIENTO:
Bernard Courtois (1777-1838) fue el químico francés de Dijon que descubrió el nuevo elemento, además de ser el descubridor de la morfina.
UBICACIÓN:
En los pescados y mariscos, ademas de algunos vegetales tales como el ajo, remolacha, acelgas, judías verdes, cebolla, champiñón, habas secas, soja en grano, Moras, piña, nueces,y leche.
En los pescados están : el Arenque, gambas, langostinos, bacalao, mero, mejillones, salmón, lenguado
y también en los huevos, pero solo en los huevos duros.
CONTAMINACIÓN:
El yodo es corrosivo, es necesario tener cuidado cuando se maneja yodo pues el contacto directo con la piel puede causar lesiones. El vapor de yodo es muy irritante para los ojos. Al mínimo contacto dar unas dosis de colirio al ojo/s. También es peligroso para las membranas mucosas. La concentración de yodo en el aire5 no debe exceder 1 mg/m³. Cuando es mezclado con amoníaco, puede formar triyoduro de nitrógeno (triyodoamina) el cual es extremadamente sensible y capaz de explotar inesperadamente.
ASTATO
PROPIEDADES:
Propiedades físicas:
Propiedades químicas:
El estado del astato en su forma natural es sólido. El astato es un elmento químico de aspecto metálico y pertenece al grupo de los halógenos. El número atómico del astato es 85. El símbolo químico del astato es At. El punto de fusión del astato es de 575 grados Kelvin o de 302,85 grados celsius o grados centígrados.
DESCUBRIMIENTO:
El astato fue sintetizado por primera vez en 1940 por Dale R. Corson, K. R. MacKenzie y Emilio Segrè en la Universidad de Berkeley (California), bombardeando bismuto con partículas alfa. Un primer nombre para el elemento fue alabamino (Ab).
UBICACIÓN:
El Astato se obtiene bombardeando Bismuto con partículas alfa, obteniendo isótopos 209At y 210At, con un periodo de semidesintegración relativamente alto y no tiene ningún uso conocido hasta ahora.
CONTAMINACIÓN:
La cantidad total de ástato en la corteza terrestre es menor de 30 gramos y solo unos pocos microgramos han sido producidos artificialmente. Esto, junto con su corta vida, no deja ninguna razón para considerar los efectos del ástato en la salud humana. El astato se estudia en unos pocos laboratorios de investigación donde su alta radiactividad requiere precauciones y técnicas de manipulación especiales.
2.- Grupo VI-A

ELEMENTOS:
- Oxígeno.
- Azufre
- Selenio
- Telurio
- Polonio
PROPIEDADES GENERALES:
• Es llamado también anfígenos y calcógenos.
• Ganan o ceden electrones al formar compuestos.
• Aunque todo ellos tienen seis electrones de valencia, sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta su número atómico.
OXÍGENO
PROPIEDADES:
Propiedades físicas:

Propiedades químicas:
Una de las propiedades de los elementos no metales como el oxígeno es por ejemplo que los elementos no metales son malos conductores del calor y la electricidad. El oxígeno, al igual que los demás elementos no metales, no tiene lustre. Debido a su fragilidad, los no metales como el oxígeno, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
DESCUBRIMIENTO:
El oxígeno fue descubierto por el farmacéutico sueco Carl Wilhelm Scheele, que produjo oxígeno gaseoso calentando óxido de mercurio y varios nitratos alrededor de 1772.
UBICACIÓN:
El oxígeno, que es un elemento gaseoso, insípido e incoloro, se encuentra distribuido en toda la naturaleza. Conforma casi la mitad de la Tierra: está en el aire, que contiene un 21% de este gas fundamental para los seres vivos; en el agua ( compuesta por un 88,8 % de oxígeno), y en las rocas, además de hallarse en todos los tejidos vivos y en numerosas sustancias.
CONTAMINACIÓN:
El O2 gaseoso puede ser tóxico a presiones parciales elevadas, produciendo convulsiones y otros problemas de salud.83 nota 14 100 La toxicidad generalmente comienza a aparecer con presiones parciales de más de 50 kPa o 2,5 veces la presión parcial del O2 a nivel del mar (21 kPa; igual a alrededor del 50 % de la composición del oxígeno a presión normal).
AZUFRE
PROPIEDADES:
Propiedades físicas:

Propiedades químicas:
Una de las propiedades de los elementos no metales como el azufre es por ejemplo que los elementos no metales son malos conductores del calor y la electricidad. El azufre, al igual que los demás elementos no metales, no tiene lustre. Debido a su fragilidad, los no metales como el azufre, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
DESCUBRIMIENTO:
El azufre es conocido desde la Antigüedad, y ya los egipcios lo utilizaban para purificar los templos.
Durante toda la Edad Media se vinculó a Satanás con los olores sulfurosos (relacionados con los volcanes, que se suponían eran entradas a los infiernos subterráneos).
Dicho elemento es generado en estrellas masivas en las que predominan temperaturas que provocan la fusión entre un núcleo de silicio y otro de helio.
UBICACIÓN:
El azufre,es un elemento muy abundante en la corteza terrestre, se encuentra en grandes cantidades combinado en forma de sulfuros (pirita, galena) y de sulfatos (aljez). En forma nativa se encuentra en las cercanías de aguas termales, zonas volcánicas y en menas de cinabrio, galena, esfalerita y estibina, y se extrae mediante el proceso Frasch consistente en inyectar vapor de agua sobrecalentado para fundir el azufre que posteriormente es bombeado al exterior utilizando aire comprimido.
CONTAMINACIÓN:
El disulfuro de carbono, el sulfuro de hidrógeno (sulfhídrico), y el dióxido de azufre deben manejarse con precaución.
El sulfhídrico y algunos de sus derivados, los mercaptanos, son bastante tóxicos (más que el cianuro).
SELENIO
PROPIEDADES:
Propiedades físicas:
Propiedades químicas:
Una de las propiedades de los elementos no metales como el selenio es por ejemplo que los elementos no metales son malos conductores del calor y la electricidad. El selenio, al igual que los demás elementos no metales, no tiene lustre. Debido a su fragilidad, los no metales como el selenio, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
DESCUBRIMIENTO:
El selenio fue descubierto en 1817 por Jöns Jacob Berzelius. Al visitar la fábrica de ácido sulfúrico de Gripsholm observó un líquido pardo rojizo que calentado al soplete desprendía un olor fétido que se consideraba entonces característico y exclusivo del telurio —de hecho su nombre deriva de su relación con este elemento ya que telurio proviene del latín Tellus, la Tierra— resultando de sus investigaciones el descubrimiento del selenio.
UBICACIÓN:
El selenio se encuentra muy distribuido en la corteza terrestre en la mayoría de las rocas y suelos se halla en concentraciones entre 0,1 y 2,0 ppm. Raramente se encuentra en estado nativo obteniéndose principalmente como subproducto de la refinación del cobre ya que aparece en los lodos de electrólisis junto al telurio (5-25% Se, 2-10% Te). La producción comercial se realiza por tostación con cenizas de sosa o ácido sulfúrico de los lodos.
CONTAMINACIÓN:
El selenio está considerado un elemento peligroso para el medio ambiente por lo que sus compuestos deben almacenarse en áreas secas evitando filtraciones que contaminen las aguas. Los residuos de selenio se tratan en solución ácida con sulfito de sodio, calentándolo después para obtener el selenio elemental que presenta una menor biodisponibilidad.
TELURO
PROPIEDADES:
Propiedades físicas:
Propiedades químicas:
El telurio forma parte de los elementos denominados metaloides o semimetales. Este tipo de elementos tienen propiedades intermedias entre metales y no metales. En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el telurio, son semiconductores.
DESCUBRIMIENTO:
El telurio es un metaloide descubierto el 13 de abril de 1782 en minerales de oro por el geólogo y químico Franz-Joseph Müller von Reichenstein (1740-1825), inspector jefe de minas en Transilvania (Rumania).
UBICACIÓN:
El telurio puede obtenerse combinado con oro en la calaverita, un mineral metálico relativamente poco abundante.
CONTAMINACIÓN:
1.- SALUD: los compuestos de teluro son teratógenos y deben ser manejados solo por personal cualificado porque su ingestión provoca mal aliento y un espantoso olor corporal.
2.- MEDIO AMBIENTE: no es peligroso o se transforma fácilmente en productos inocuos. Si se caliente para descomponerlo el cloruro de teluro puede emitir vapores tóxicos de teluro y cloro.
POLONIO
PROPIEDADES:
Propiedades físicas:
Propiedades químicas:
El polonio forma parte de los elementos denominados metaloides o semimetales. Este tipo de elementos tienen propiedades intermedias entre metales y no metales. En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el polonio, son semiconductores.
DESCUBRIMIENTO:
También conocido como Radio F, el polonio fue descubierto por Pierre Curie y Marie Curie-Skłodowska en 1898, y fue posteriormente renombrado en honor a la tierra natal de Marie Curie, Polonia.
UBICACIÓN:
Aunque es un elemento de procedencia natural, sólo está presente en los minerales de uranio natural a razón de 100 microgramos por tonelada.
CONTAMINACIÓN:
Es muy tóxico, radiactivo y de manejo muy peligroso. Se necesita una manipulación especial con muchas normas de seguridad.
el polonio 210 se encuentra en el humo del tabaco y tiene efectos cancerígenos en pulmón.
3.- GRUPO 5-A

ELEMENTOS:
- Fósforo.
- Arsénico
- Antimonio
- Bismuto
PROPIEDADES GENERALES:
• También llamados elementos nitrogenoides.
• Conforman el 0.33% de la corteza terrestre.
• No reaccionan con el agua o con los ácidos no oxidantes.
NITRÓGENO
PROPIEDADES:
Propiedades físicas:
Propiedades químicas:
Una de las propiedades de los elementos no metales como el nitrógeno es por ejemplo que los elementos no metales son malos conductores del calor y la electricidad. El nitrógeno, al igual que los demás elementos no metales, no tiene lustre. Debido a su fragilidad, los no metales como el nitrógeno, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
APLICACIONES:
- El nitrógeno se utiliza para conservar los alimentos envasados al detener la oxidación de los alimentos que hace que se estropeen.
- Las bombillas pueden contener nitrógeno como una alternativa más barata al argón.
- El gas nitrógeno se utiliza a menudo en la parte superior de los explosivos líquidos para evitar que se detonen.
- El nitrógeno se usa para producir muchas piezas eléctricas tales como transistores, diodos y circuitos integrados.
- Cuando se seca y se presuriza, el gas nitrógeno se usa como un gas dieléctrico para equipos de alta tensión.
- Se utiliza para la fabricación de acero inoxidable.
FÓSFORO
PROPIEDADES:
Propiedades físicas:

Propiedades químicas:
Una de las propiedades de los elementos no metales como el fósforo es por ejemplo que los elementos no metales son malos conductores del calor y la electricidad. El fósforo, al igual que los demás elementos no metales, no tiene lustre. Debido a su fragilidad, los no metales como el fósforo, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
APLICACIONES:
- Los fosfatos se utilizan para hacer vidrio especial que se utiliza como en las lámparas de sodio.
- El fósforo es un nutriente esencial para las plantas, por lo que se añade a los fertilizantes.
- En el laboratorio, dos isótopos radiactivos de fósforo se puede utilizar como trazadores radiactivos.
- El fosfato de calcio se puede utilizar para hacer porcelana fina.
- Las cabezas de las cerillas están hechos de fósforo. Las bengalas y los fósforos de seguridad también están hechos de fósforo.
ARSÉNICO
PROPIEDADES:
Propiedades físicas:
Propiedades químicas:
El arsénico forma parte de los elementos denominados metaloides o semimetales. Este tipo de elementos tienen propiedades intermedias entre metales y no metales. En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el arsénico, son semiconductores.
APLICACIONES:
- El uso principal de arsénico metálico es el fortalecimiento de las aleaciones de cobre y plomo para su uso en baterías de coche.
- También se utiliza como un dopante de tipo n en dispositivos semiconductores electrónicos (como los diodos).
- El arsénico también se utiliza en numerosos pesticidas, herbicidas e insecticidas, aunque esta práctica se está volviendo menos común ya que cada vez más productos de este tipo están prohibidos.
- Se ha utilizado como un conservante de madera debido a su toxicidad para los insectos, bacterias y hongos.
- El arsénico se añade a los alimentos de animales para prevenir enfermedades y favorecer su crecimiento.
ANTIMONIO
PROPIEDADES:
Propiedades físicas:

Propiedades químicas:
El antimonio forma parte de los elementos denominados metaloides o semimetales. Este tipo de elementos tienen propiedades intermedias entre metales y no metales. En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el antimonio, son semiconductores.
APLICACIONES:
- Se usa en la producción de diodos, dispositivos de efecto Hall, semiconductores y detectores infrarrojos.
- En aleaciones con estaño (en el metal antifricción), en el peltre, metal inglés, etc. Se utiliza también en baterías y acumuladores donde aleado con plomo da resistencia a la corrosión, en cojinetes y rodamientos y en tipos de imprenta
- Es un componente menor en soldaduras suaves.
- Los compuestos de antimonio se utilizan en la fabricación de materiales resistentes al fuego, en esmaltes, vidrios, pinturas. El trióxido de antimonio es retardante de llama.
BISMUTO
PROPIEDADES:
Propiedades físicas:

Propiedades químicas:
La masa atómica de un elemento está determinado por la masa total de neutrones y protones que se puede encontrar en un solo átomo perteneciente a este elemento. En cuanto a la posición donde encontrar el bismuto dentro de la tabla periódica de los elementos, el bismuto se encuentra en el grupo 15 y periodo 6. El bismuto tiene una masa atómica de 208,98038 u.
APLICACIONES:
- Sustituto del plomo.
- Cosméticos y pigmentos.
4.- Tabla Periódica
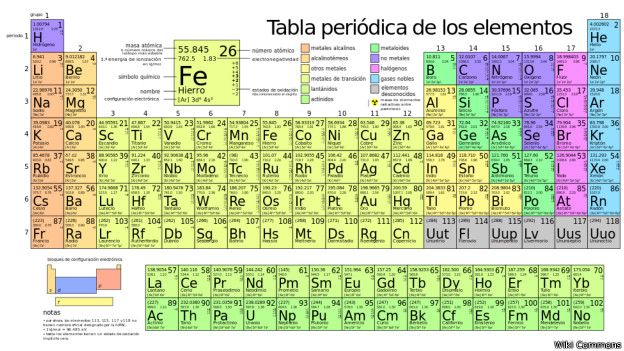
CONCEPTO:
Es la disposición de los elementos en forma de tabla, ordenados por su número atómico, por su configuración de electrones y sus propiedades químicas.
GRUPOS Y PERIODOS:

- Grupos: A las columnas verticales de la tabla periódica se las conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar.
- Periodos: Las filas horizontales de la tabla periódica son llamadas períodos.61 El número de niveles energéticos de un átomo determina el periodo al que pertenece.
METALES:

- Características de los metales:
Los metales constituyen la gran mayoría de la tabla periódica (88 elementos en total) y tienen características únicas. La característica más obvia es que, a excepción del mercurio, son sólidos a temperatura ambiente. También son relativamente densos, susceptibles a la corrosión, conducen la electricidad y calor, son dúctiles (se pueden convertir en los cables) y maleables (pueden convertirse en láminas).
- Lista de metales
NO METALES:

- Características de los no metales
- Lista de los no metales
METALOIDES:

- Características de los metaloides
- Lista de metaloides
ALCALINOS:

Los metales alcalinos, litio ( li ), sodio ( na ), potasio ( k ), rubidio ( rb ), cesio ( cs ) y francio ( fr ), son metales blandos de color gris plateado que se pueden cortar con un cuchillo.
Presentan densidades muy bajas y son buenos conductores de calor y la electricidad; reaccionan de inmediato con el agua, oxigeno y otras substancias químicas, y nunca se les encuentra como elementos libres (no combinados) en la naturaleza.
ALCALINO-TÉRREOS:

Los Metales alcalinos térreos constituyen algo más del 4% de la corteza terrestre (sobre todo calcio y magnesio), pero son bastante reactivos y no se encuentran libres. El radio es muy raro. Se obtienen por electrólisis de sus haluros fundidos o por reducción de sus óxidos.
Son metales ligeros con colores que van desde el gris al blanco, con dureza variable (el berilio es muy duro y quebradizo y el estroncio es muy maleable). Son más duros que los alcalinos.
HALÓGENOS:

Los fenicios y los griegos de la antigüedad utilizaron la sal común para la conservación de alimentos, especialmente en la salazón del pescado.
Proviene del griego hals, 'sal'; genes, 'nacido', en química, cinco elementos químicamente activos, estrechamente relacionados, el principal de ellos es el cloro; los otros tres son: el flúor, el bromo y el yodo, que forman el grupo 17 (o VIIA) de la tabla periódica de clasificación de los elementos químicos.
GASES NOBLES:

Los gases nobles son incoloros, inodoros, insípidos y no inflamables en condiciones normales. Los gases nobles (tambien conocidos como gases inertes) presentan una reactividad química muy baja. Los seis gases nobles que se encuentran en la naturaleza son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y el radioactivo radón (Rn). Se sitúan en el grupo 18 (8A) de la tabla periódica (anteriormente llamado grupo 0).
5.- Átomo de carbono
El carbono tiene un número atómico de seis, lo que significa que teine seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
CLASES DE COMPUESTOS:
• HIDROCARBUROS: Son compuestos que solo contienen átomos de carbono e hidrógeno. Según el tipo de enlace carbono-carbono, pueden ser:
-Alcanos: Todos los enlaces son sencillos.
-Alquenos: Tienen al menos un enlace doble.
-Alquinos: Presentan al menos un enlace triple.
-Reacción de combustión de los hidrocarburos. Con suficiente oxígeno, se produce CO2 y H2O:
C4H10 + 13/2 O2 -> 4CO2 + 5H2O + 2876,9 KJ/mol
• COMPUESTOS OXIGENADOS: Son aquellos que presentan oxígeno en algunos de sus grupos funcionales. Los más importantes son los siguientes:
-Alcoholes: Tienen el grupo funcional –OH.
-Aldehídos: Grupo –CHO en carbono primario.
-Cetonas: Grupo –CHO en carbono secundario.
-Ácidos carboxílicos: Grupo funcional –COOH.
• COMPUESTOS NITROGENADOS: Son aquellos que contienen nitrógeno en sus grupos funcionales. Los más importantes son los siguientes:
-Aminas: Resultan de la sustitución de los hidrógenos del NH3 por radicales alquílicos.
-Amidas: Derivan de los ácidos carboxílicos al sustituir el grupo –OH por el –NH2
• POLÍMEROS: Son moléculas grandes formadas por la unión de muchas moléculas pequeñas e iguales llamadas monómeros.
6.- PROPIEDADES GENERALES:
Entre las propiedades generales del carbono, tenemos:
• Tetravalencia
El químico alemán Federico Kekulé enunció su teoría estructural, bajo 3 postulados para establecer las fórmulas estructurales planas de los compuestos orgánicos:
- El átomo de carbono es tetravalente
- Las cuatro valencias son exactamente iguales
- Los átomos de carbono pueden unirse consigo mismos mediante enlaces formando cadenas.

• Covalencia
El átomo de carbono que tiene 4 electrones en su último nivel de energía, no gana ni pierde electrones, sino al combinarse los comparte con otros átomos formando enlaces covalentes.
• Igualdad de valencias
Propiedad del átomo de carbono, de representar en el centro de un tetraedro regular, con sus valencias dirigidas hacia los vértices a igual distancia del átomo de carbono (equidistantes), que tomó el nombre de “Isovalencia” o igualdad de sus valencias.
• Autosaturación
Propiedad del átomo de carbono que lo distingue de los demás elementos y se refiere a la capacidad que tienen para unirse entre si, para formar cadenas carbonadas lineales o ramificados, cíclicas o abiertas compartiendo una, dos, tres pares de electrones de valencia (enlaces covalentes).

• Concatenación
Se debe a que el átomo de carbono puede formar extensas cadenas carbonadas que pueden ser alifáticas o abiertas, cíclicas o cerradas.
• Hibridación
Función de los orbitales, de diferente energía del mismo nivel, para dar como resultado orbitales de energía constante.
La hibridación del átomo de carbono, dependiendo del tipo de compuesto que va a formar lo hace de 3 maneras:
- Hibridación sp3 , enlace simple
- Hibridación sp2 , enlace doble
- Hibridación sp1 , enlace triple

7.- Química orgánica
Existen cuatro tipos de carbono primario, secundario, terciario y cuaternario
Primario:
El carbono se considera primario si ésta unido a un solo átomo de carbono.
CH3-CH2-CH3
Los carbonos que están en morado se consideran primarios; ya que están unidos a un
solo átomo de carbono que es el central.
Secundario:
Esta unido a dos átomos de carbono.
CH3-CH2-CH3
El carbono del centro está ligado a los dos átomos de los lados; por lo tanto se considera
secundario.
Terciario:
Se liga a tres átomos de carbono.
CH3-CH-CH3
CH3
De nuevo el carbono del centro es terciario ya que se encuentra unido a los elementos de
los lados y él de abajo.
Cuaternario:
Unido a cuatro átomos de carbono y no tiene hidrógenos.
CH3
CH3-
C-CH3
CH3
El átomo del centro se encuentra unido a los 4 elementos que se encuentran a su
alrededor, de tal manera se le llama cuaternario.